Tomografica crioelettronica
La tomografia crioelettronica (CryoET) viene utilizzata per risolvere le biomolecole all'interno del proprio ambiente cellulare fino a una risoluzione senza precedenti nella scala subnanometrica, aprendo la strada alla comprensione della sociologia molecolare. Si tratta di una scala in cui le singole proteine possono essere identificate in base esclusivamente alla loro forma, senza alcuna marcatura. Tuttavia, l'imaging a risoluzione subnanometrica prevede di affrontare una sfida importante: è necessario individuare e puntare con precisione i siti di interesse.
Le soluzioni avanzate CryoET di Leica Microsystems utilizzano la criomicroscopia ottica per selezionare in modo rapido e ad alta risoluzione e correlare le immagini, il tutto mantenendo condizioni di crioconservazione ottimali durante l'intero flusso di lavoro.
Per consigli esperti su come risolvere i problemi più comuni del workflow di tomografia crioelettronica, non esitare a contattarci.
In cosa consiste la tomografica crioelettronica?
La tomografia crioelettronica (nota anche come criotomografia elettronica) consente di analizzare le interazioni proteina-proteina ad una risoluzione molecolare tridimensionale nel proprio stato originale e funzionale. Il campione viene riprodotto in una serie di immagini bidimensionali mentre viene inclinato in una serie controllata di posizioni. Le “fette” risultanti possono quindi essere combinate per creare una ricostruzione del campione in 3D.
Quali sono le sfide di un tipico workflow CryoET?
La sfida più grande associata a un tipico workflow CryoET è relativa alla difficoltà di identificare l'area di interesse precisa che contiene la cellula o la proteina da sottoporre a imaging. Errori ripetuti nel puntamento possono causare ripetizioni multiple di un processo che richiede molto tempo, che in ultima analisi spreca preziosi tempi di acquisizione al microscopio elettronico (EM). Altre due sfide nel workflow includono la garanzia che la qualità del campione e lo spessore del ghiaccio siano uniformi durante tutto il periodo di analisi, nonché la conservazione dei campioni adeguatamente vetrificati prima di essere trasferiti al crio-TEM.
Quali sono i passaggi di un tipico workflow CryoET?
La tecnica prevede la preparazione di campioni, che si trovano sulle griglie per microscopia elettronica che devono essere immersi in azoto liquido congelandosi rapidamente per vetrificare il campione e prevenire la formazione di cristalli di ghiaccio.
Per eseguire la criotomografia ad alta risoluzione, lo spessore della sezione del campione da analizzare non deve essere superiore a 300 nm. Per l'osservazione delle parti "più spesse" dei campioni, come i corpi cellulari, è necessario assottigliare il campione. Oltre all'ultramicrotomia criogenica, anche la macinazione a fascio ionico focalizzato (FIB) con un criomicroscopio a scansione elettronica dedicato o multimodale rappresenta il metodo d'elezione. Due finestre di fascio ionico vengono posizionate in modo da creare un sottile strato di ghiaccio (lamella) con uno spessore di circa 200 nm nell'area di interesse per renderlo accessibile al Cryo ET.
I campioni preparati possono quindi essere scansionati con il criomicroscopio elettronico a trasmissione e, successivamente, è necessario eseguire il processo di ricostruzione dei dati per ricomporre le immagini in 2D in un singolo modello in 3D.
Come si possono superare le sfide di CryoET utilizzando la criomicroscopia ottica?
La criomicroscopia ottica può contribuire positivamente al flusso di lavoro CryoET in due modi importanti.
In primo luogo, la microscopia ottica aiuta a valutare la qualità del campione. Il criomicroscopio ottico garantisce una rapida panoramica della qualità del congelamento e dello spessore del ghiaccio del campione, nonché della distribuzione ottimale del campione per un trattamento ulteriore. Le soluzioni crio sviluppate da Leica garantiscono la sicurezza e la vitalità dei campioni durante queste fasi.
In secondo luogo, la capacità del criomicroscopio ottico di garantire un workflow più efficiente consiste nella capacità di selezionare la struttura di interesse in modo molto più preciso prima degli step preparativi CryoEM, costose in termini di tempo e risorse economiche. Le soluzioni di criomicroscopia ottica di Leica consentono l'esportazione di immagini e coordinate della struttura target verso fasi successive di EM, riducendo notevolmente il tempo di imaging EM.

Presentazione di Coral Cryo: il flusso di lavoro CryoET più efficace di sempre
Le soluzioni Leica dedicate ai workflow della tomografia crioelettronica in 3D, superano le sfide comuni garantendo la vitalità dei campioni, i controlli di qualità e, soprattutto, un meccanismo di puntamento 3D preciso e affidabile. Sfrutta l’hardware ottimizzato, incluso il tavolino criogenico e lo shuttle, in combinazione con il software di puntamento all’avanguardia CryoET, nonché con molteplici opzioni di integrazione e trasferimento continuo nei passaggi cryo FIB e VCT.
Cosa scegliere: Cryo widefield o Cryo confocale?
Caratteristiche | Confocale | Thunder (widefield) |
|---|---|---|
| Sensibilità | * | |
| Velocità | * | |
| Risoluzione laterale | ** | * |
| Risoluzione assiale | ** | * |
| Ottimizzazione dell'eccitazione e dell'emissione di fluorocromi per assicurare condizioni di imaging criogenico | ** | * |
| Soppressione dell'autofluorescenza (campione o strato di carbonio) | * | |
| Puntamento ed esportazione | 3D | 2D |
Rendi possibile il puntamento preciso del volume in 3D
Questo articolo spiega in che modo il workflow continuo di tomografica crioelettronica Coral Cryo offerto da Leica Microsystems utilizza la super risoluzione confocale per eseguire il puntamento della struttura di interesse in modo più preciso. Il flusso di lavoro riduce e ottimizza il numero di passaggi richiesti, migliora il caricamento e il trasferimento dei campioni, migliorando pertanto la produttività del workflow CryoET.
Scopri di più
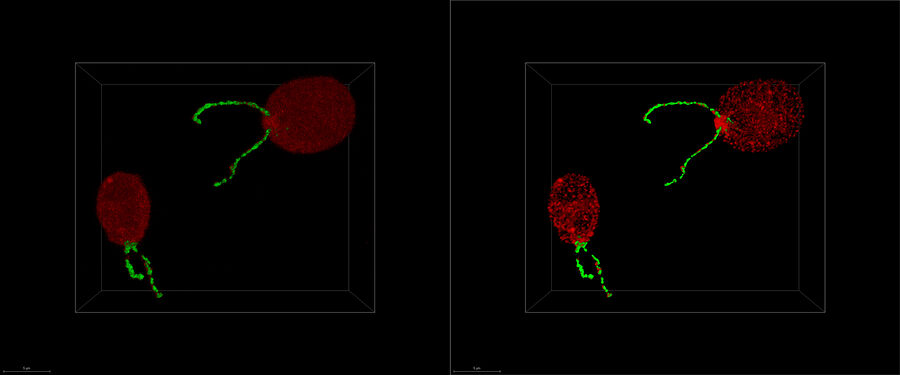
Sovrapposizione di un'immagine confocale in 3D a super-risoluzione con vista SEM dall'alto (pannello sinistro) e vista FIB (pannello destro). La sovrapposizione è stata eseguita utilizzando beads come punti di riferimento della correlazione. Cellule HeLa marcate come segue: nuclei di Hoechst, blu; mitocondri di MitoTracker Green, verde; droplet lipidici di Bodipy e Crimson beads, rosso. Scala: 20 µm. Cellule gentilmente fornite da Ievgeniia Zagoriy e immagini SEM/FIB su gentile concessione di Herman Fung, Mahamid-Group, EMBL-Heidelberg, Germania.