クライオ電子トモグラフィー
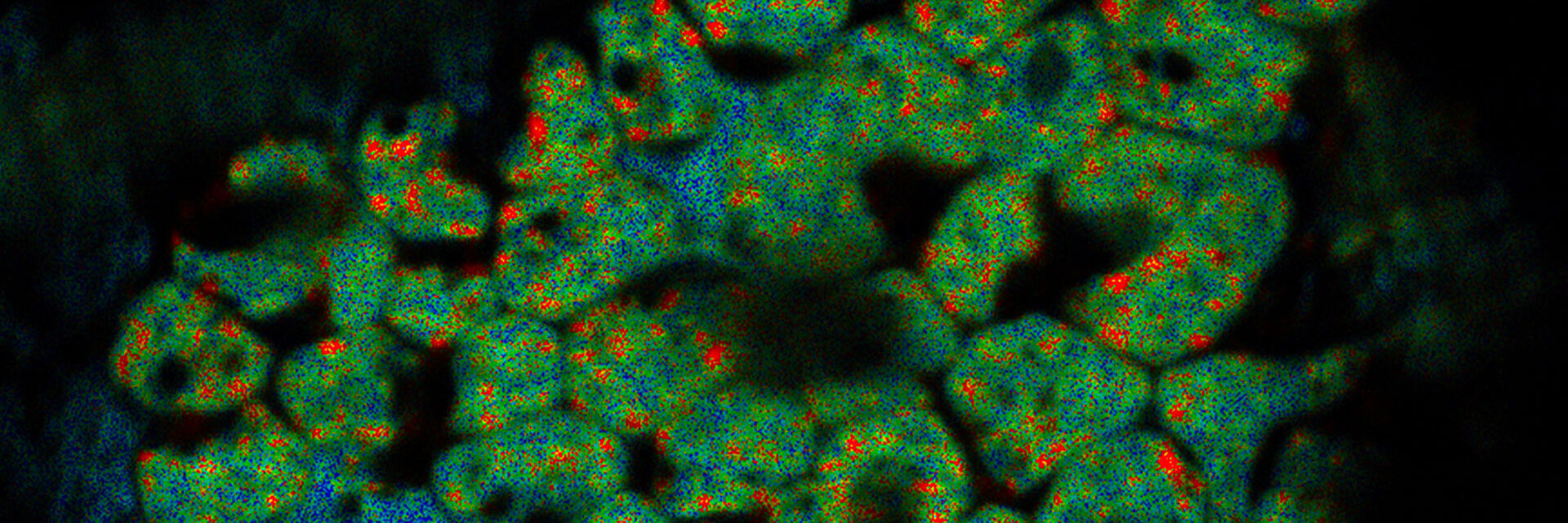
クライオ電子トモグラフィー (CryoET) は細胞環境内の生体分子をサブナノメートルという驚異の分解能に分割し、分子社会学を理解する可能性を拓きます。これは標識せずに、個々のタンパク質を形状だけで特定することが可能なレベルです。しかし、サブナノメートル分解能でのイメージングには、関心領域を正確に特定・ターゲティングしなければならないという、難しい課題があります。
ライカ マイクロシステムズの高度なCryoETソリューションは、クライオ光学顕微鏡を駆使してワークフロー全体で最適な極低温条件を保ちながら、高速の高分解能イメージングおよび画像データの正確な転送を実現します。
お問合せください -- クライオ電子トモグラフィーワークフローによく見られる課題や問題の解消法について専門的アドバイスをご提供します。
クライオ電子トモグラフィーとは何ですか?
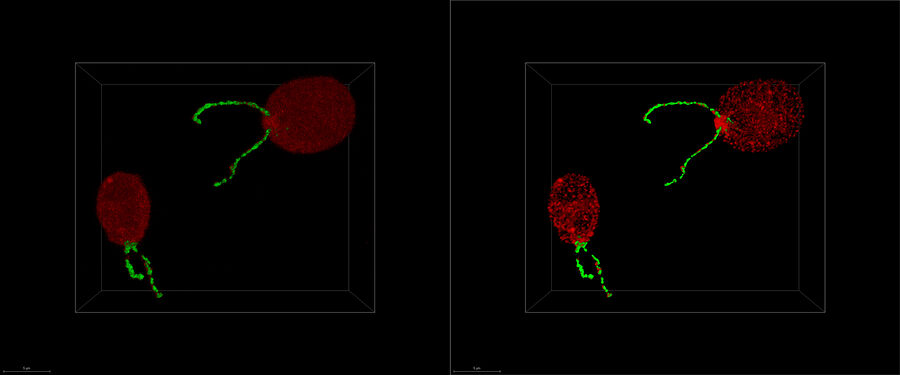
クライオ電子トモグラフィー(または、電子クライオトモグラフィー)は、タンパク質間の相互作用を自然かつ機能的な状態で立体的な分子分解能で分析することを可能にします。サンプルをさまざまなポジションに傾けた状態で、2D画像が取得されます。こうして得られた画像「スライス」を組み合わせることで、サンプルを3Dに再構成します。
一般的なCryoETワークフローにはどのような問題がありますか?
一般的なCryoETワークフローの最大の問題は、画像取得する細胞やタンパク質を含む関心領域を精密に特定しにくい点です。ターゲティングの失敗を繰り返すと、時間を浪費するプロセスの反復につながり、最終的に電子顕微鏡(EM)のイメージングタイムのコストがかさむことになります。さらに、ワークフロー全体でサンプルの品質や氷片の厚みを一貫して確保し、サンプルをクライオTEMに移送する前にガラス状に凍結した状態にしておくといった課題もあります。
高分解能のクライオトモグラフィーを実施するためには、試料の切片の厚みが300 nmを超えないことが大切です。細胞体等の試料の「より厚い」部分を観察する際は、サンプルを薄くしなければなりません。この際は、クライオウルトラマイクロトミーやマルチモードのクライオスキャニング電子顕微鏡専用の集束イオンビーム (FIB) ミリングを用いることができます。2つのイオンビームウィンドウは、厚さ200 nmの薄氷片(ラメラ)が関心領域に生じ、Cryo ETがアクセスできるように設置されます。
こうして調製されたサンプルは、クライオ透過電子顕微鏡でスキャンすることができます。その後、データ再構成プロセスで2D画像を単体の3Dモデルへ再構成する必要があります。
CryoETに関する課題はクライオ光学顕微鏡でどのように解消できますか?
クライオ光学顕微鏡は、2つの点でCryoETワークフローに貢献することができます。
第一に、光学顕微鏡はサンプルの品質を評価する上で役立ちます。クライオ光学顕微鏡は、サンプルの凍結品質と氷片の厚みを迅速に表示し、その後のプロセスに最適な形でサンプルが配置されているかを素早く提示します。ライカのクライオソリューションは、こうしたステップでサンプルの安全性および生存性を確保します。
第二に、クライオ光学顕微鏡がワークフローの効率化につながる最大の要素として、時間も費用もかかるCryoEM調製を始める前に、関心構造をはるかに正確にターゲティングすることができるという点があります。ライカのクライオ光学顕微鏡ソリューションを活用すれば、対象構造の画像や座標を後のEMステップ用にエクスポートすることができるため、EMイメージングに要する時間を大幅に短縮することが可能です。