Leica M205 FCA & Leica M205 FA 형광 실체 현미경
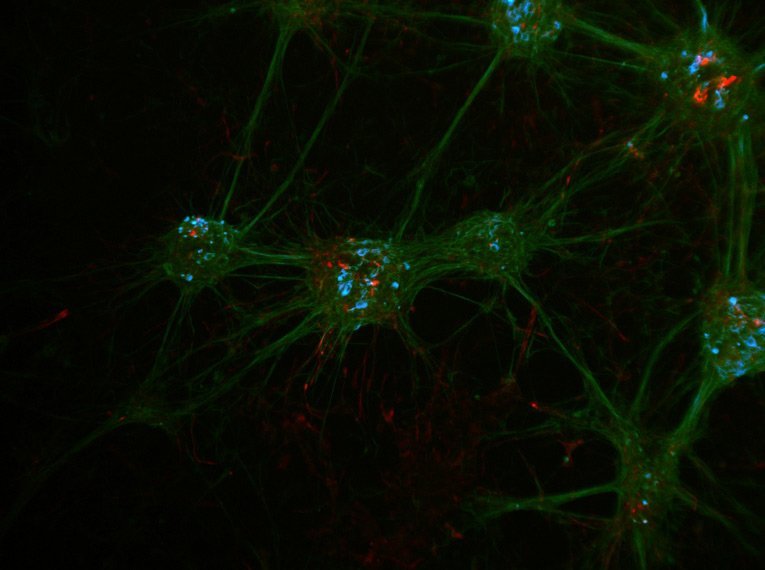
점점 희미해지고 약해지는 형광 신호를 찾느라 때때로 어둠 속에서 낚시를 하고 있는 것 같은 기분이 들 때가 있습니까? 현대 발달 생물학 및 연구에서 밝기와 고해상도 이미지는 필수 요소입니다. Leica Microsystems는 M205 FA 및 M205 FCA 형광 실체 현미경을 개발하여 GFP 및 mCherry와 같은 형질전환 발현을 초기 단계에서 감지할 수 있도록 하여 성공적인 연구의 기반이 되는 올바른 샘플을 선택할 수 있도록 합니다.
자동화된 연구 환경을 확인해보세요
예를 들어 멸균 캐비닛에서 작업할 때, Leica M205 FA는 형광 현미경 연구의 새로운 세계를 엽니다.
- 복잡한 다채널 형광 이미징 절차를 쉽게 처리합니다.
- 전동 줌, 필터 교환기, FIM(Fluroescence Intensity Manager) 및 조리개로 까다로운 실험을 수행하십시오.
- 재물대 수준에서 고해상도 확보: Leica LMT 260 스캐닝 스테이지는 샘플을 sub-um 범위에 배치하고 생명 세포 배양 장비도 결합함으로써 생세포 이미징도 가능합니다.
이제 모든 것을 가질 수 있습니다.
- 모든 매개변수가 항상 자동으로 저장되므로 매우 신뢰할 수 있고 논문에 실을 수 있는 결과를 얻을 수 있습니다.
- 4개 필터에 대한 코드식 변환으로 여러분의 실험 과정에 방해 요소를 제거해줍니다.
- 필터, 초점 및 조명 조정을 편리하게 변경할 수 있는 풋 스위치를 추가하여 두 손을 자유롭게 유지하며 스크리닝을 수행할 수 있습니다.
항상 밝은 형광 신호
시료의 가장 희미한 신호까지 감지하려면 밝은 형광 신호를 제공하는 에너지가 풍부한 여기(excitation) 조명이 필요합니다.
그러나 여기광(excitation light)은 검은 백그라운드를 흐리게 하고, 형광 신호의 감지를 손상시키는 반사(간섭)를 일으킬 수 있습니다.
라이카의 TripleBeam 기술은 세 번째 광학 줌을 도입하여 이러한 백그라운드 '노이즈'를 완전히 제거합니다. 이는 두 개의 관찰 채널에서 형광 여기광을 분리하고 이분성 거울(dichroic mirror)의 필요성을 제외시킵니다.
그 결과 노이즈가 없는 검은색 백그라운드에 명확하고 강한 형광 신호가 생성됩니다.
3D의 가장 섬세한 디테일
고해상도와 최대 피사계 심도(depth of field)는 현미경에서 양립할 수 없는 정반대 개념이라고 생각하십니까? 라이카는 그렇지 않다는 것을 증명합니다! Leica Microsystems의 FusionOptics 기술은 서로 다른 작업에 두 개의 빔 경로를 사용하여 광학적 한계를 극복합니다.
- 오른쪽 채널은 가능한 가장 큰 개구수에서 고해상도 이미지를 제공합니다.
- 왼쪽 채널은 심도가 높은 이미지를 나타냅니다.
그 결과, 디테일의 풍부함과 뛰어난 피사계 심도를 동시에 가진 하나의 이미지로 인식합니다.
스테레오의 미세한 해상도
연구에서는 특히 작은 유기체로 작업할 때 미세한 세부 사항을 인식하는 것이 중요합니다. Leica M205 FA 및 M205 FCA는 ISO18221*에 정의된 해상도 제한을 기반으로 1279 lp/mm 또는 0.78 µm의 해상도를 달성할 수 있습니다.
2.0x PlanApo 대물렌즈는 최대 0.35의 개구수(NA) 값을 가진 광학적 걸작이라고 할 수 있습니다. 이는 지금까지 실체 현미경으로 달성된 가장 높은 개구수(NA)로, 인간 적혈구 직경의 10분의 1보다 작습니다.
*M205 FA, 2x PlanAPO 대물렌즈, 카메라 어댑터 0.63x, 전체 프레임 모드의 DMC4500 카메라, 27인치 모니터가 있는 Apple 5K.
작업 속도에 도움을 주는 인코딩 기능
Image Coding은 빠르고 쉬운 문서화를 위해 편리하고 재현 가능한 설정을 제공합니다.
통합된 인코딩은 조리개의 배율과 위치를 소프트웨어에 실시간으로 전송합니다. 스케일 바는 라이브 이미지에 오버레이되며 배율이 변경되면 업데이트됩니다. 이미지가 저장되면 모든 설정이 이미지와 함께 저장되며 언제든지 불러올 수 있습니다.
- 코딩된 구성 요소는 교육을 받지 않은 작업자도 사용하기 쉽고 신뢰할 수 있는 결과를 제공합니다.
- 현미경 시스템은 소프트웨어에 지능적으로 연결되어 수동으로 보정을 조정할 필요 없이 설정을 변경할 수 있습니다.
- TL5000 Ergo 투과광 베이스는 최적의 대비(contrast)를 제공하기 위해 자동으로 조리개를 줌 위치에 맞게 조정합니다.
2 x CORR 대물렌즈로 선명하게!
Leica PLAN APO 2.0x CORR 대물렌즈를 사용하면 굴절률을 조정할 수 있습니다. 이렇게 하면 샘플과 대물렌즈 사이에 5mm의 물이 있어도 핀처럼 샤프하고 선명한 이미지를 얻을 수 있습니다. 이 대물렌즈를 통해 마치 물이 존재하지 않는 것처럼 샘플을 관찰하고 문서화할 수 있습니다.
수용액에 담긴 샘플을 관찰할 때 특히 고배율에서 구조가 흐려지는 경향이 있습니다. 이는 공기(지수 = 1)와 물(지수 = 1.3)의 굴절률이 일치하지 않기 때문입니다. 잠재적으로 흥미롭거나 중요한 구조는 발생할 수 있는 구면 수차로 인해 쉽게 잘못 해석될 수 있습니다. 일반 대물렌즈는 공기(Dry Type)만으로 둘러싸인 샘플과 함께 사용하기 때문입니다.
생명 과학을 위한 LAS X 소프트웨어 살펴보기
LAS X는 모든 Leica 현미경 솔루션을 위한 소프트웨어 플랫폼으로, 복잡한 형광 실험을 쉽게 진행할 수 있습니다. LAS X는 전체 분석 워크플로우를 단계별로 안내합니다.
- 라이브 데이터 모드: 실험 패턴 설계 및 환경 제어
- 확장된 초점 심도(ED(O)F)
- 디콘볼루션 돌린 Z-스택에 XY의 결합으로 견줄수 없는 넓은 영역의 이미지를 생성