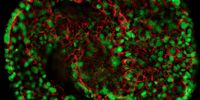
STED – Ottica super-risoluzione
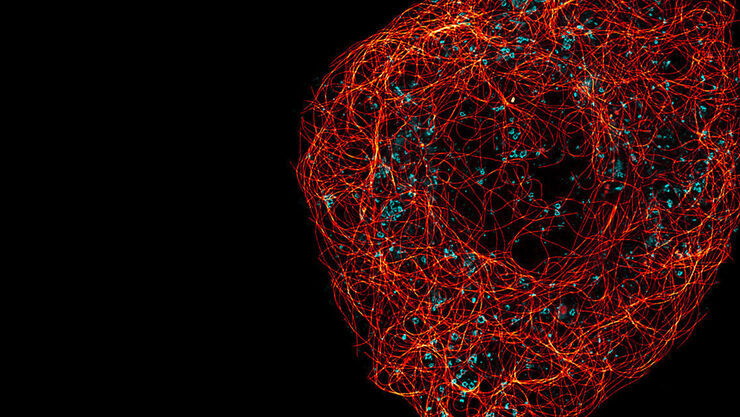
La super-risoluzione STED consente di studiare più eventi dinamici simultaneamente, in modo da poter studiare le relazioni molecolari e i meccanismi all'interno del contesto cellulare.
DIVE – Esperimenti in vivo in profondità
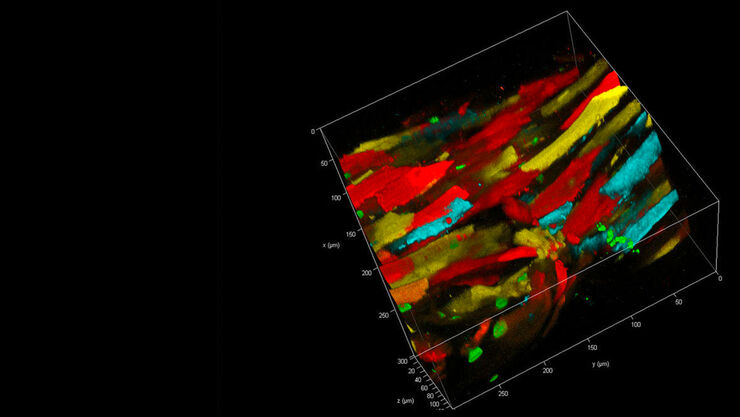
Adesso DIVE e STELLARIS sono stati uniti per offrirti la potenza dell'imaging multifotone flessibile e multicolore. Grazie a 4Tune, un detector spettralmente regolabile non-descanned, è possibile definire simultaneamente fino a quattro bande di detection.
FALCON – FAst Lifetime CONtrast
Lifetime imaging in un instante. STELLARIS 8 FALCON (FAst Lifetime CONtrast) rappresenta il futuro dell'imaging funzionale. Sfrutta la potenza dei tempi di vita della fluorescenza per investigare la fisiologia cellulare ed esplorare le dinamiche presenti nelle cellule vive.
DLS – Digital Light Sheet
Con DLS (Microscopio Digital Light Sheet) puoi beneficiare di tutto il potenziale di un microscopio confocale e di un sistema di fogli di luce facile da usare e rendere la tua ricerca più versatile.
Cryo - Tomografia crioelettronica
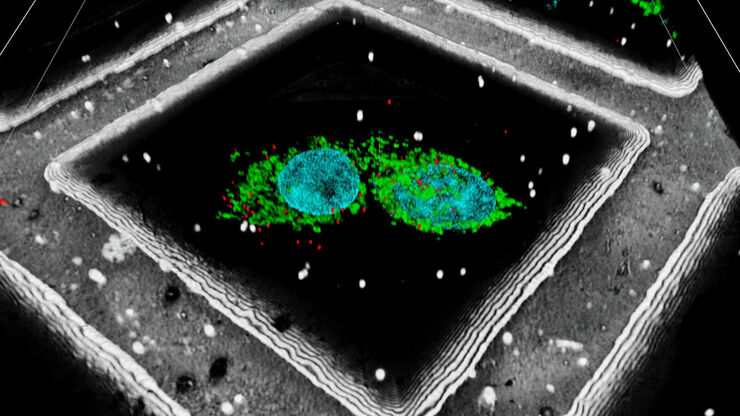
STELLARIS Cryo è un microscopio confocale che consente di puntare sulla zona di interesse per eseguire la cryo-electron tomography (CryoET). STELLARIS Cryo ti consente di selezionare in modo affidabile un'area con precisione, garantendo al tempo stesso prestazioni superiori e sicurezza dei campioni nella conduzione degli esperimenti.
CRS – Imaging senza marcatori
Il contrasto dell'immagine nella microscopia CRS è generato dai caratteristici, intrinseci stati vibrazionali delle diverse molecole che compongono il campione. Pertanto, non è necessaria alcuna colorazione del campione, eliminando gli inconvenienti dei metodi di imaging a base di coloranti, come il fotobleaching e possibili artefatti dovuti alla colorazione.
Cos'è un microscopio confocale?
La microscopia confocale a scansione laser (CLSM) riproduce i campioni mediante sezionamento ottico. Il vantaggio dell'imaging confocale è un contrasto notevolmente aumentato grazie alla rimozione dei segnali di fluorescenza fuori fuoco. È particolarmente adatto per l'imaging time-lapse, la microscopia di imaging in tempo di vita a fluorescenza (FLIM), il recupero della fluorescenza dopo il fotobleaching (FRAP), il trasferimento di energia di risonanza di Förster (FRET) e le misure di spettroscopia di correlazione di fluorescenza (FCS).
Per cosa vengono utilizzati i microscopi confocali?
I microscopi confocali sono spesso utilizzati per la visualizzazione e l'analisi di strutture subcellulari e biomolecole, come le proteine, in campioni fissati e vivi. Puoi trovare maggiori informazioni sulle applicazioni in cui viene utilizzata la microscopia confocale su Science Lab, il portale informativo sulla microscopia di Leica Microsystems.
Quando è stato inventato il microscopio confocale?
Nel 1957, Marvin Minsky richiese un brevetto che conteneva per la prima volta la descrizione di un microscopio confocale funzionante, ma fu ampiamente ignorato dalla comunità scientifica. Il metodo è stato ampiamente migliorato nel corso degli anni grazie ai progressi della tecnologia laser e dei rilevatori. Negli anni '80, la microscopia confocale è diventata una tecnica generalmente accettata e popolare.
Microscopi confocali
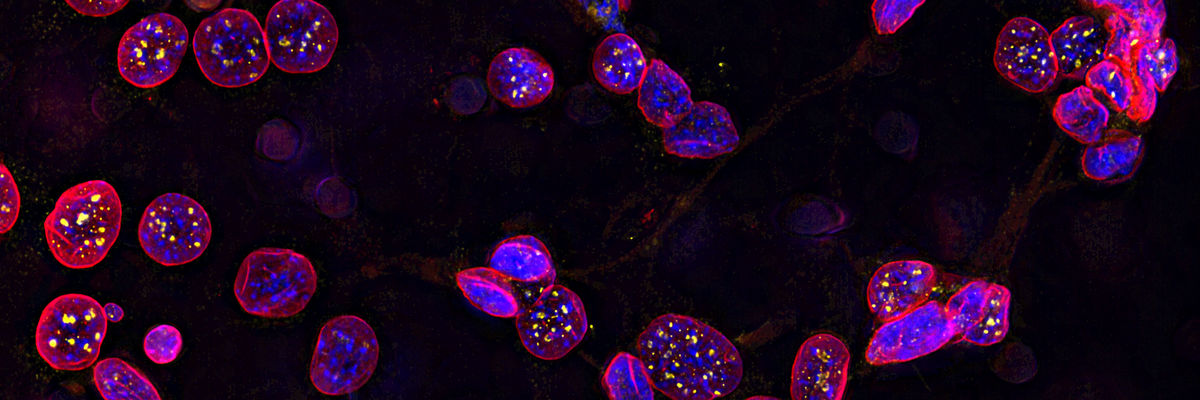
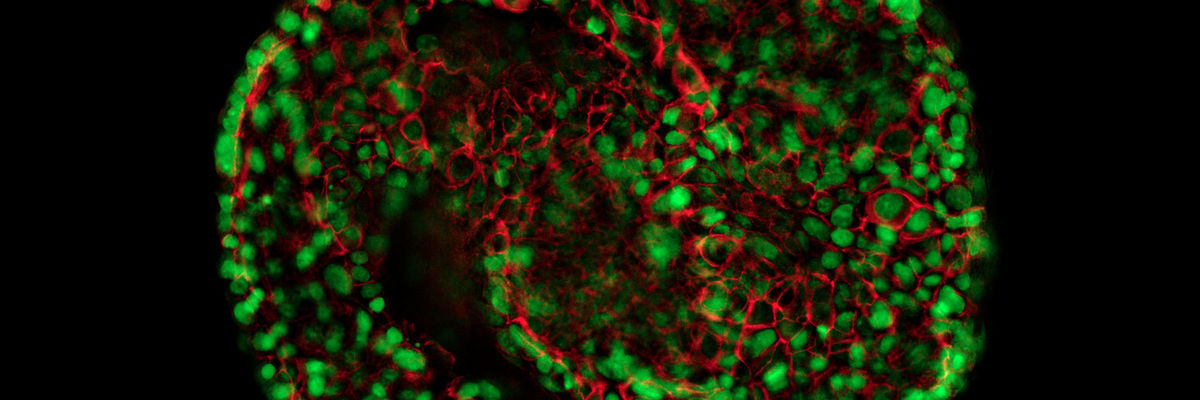
I microscopi confocali di Leica Microsystems sono partner ideali nell'ambito della ricerca biomedica di alto livello e dell'analisi delle superfici nelle applicazioni della scienza dei materiali, consentendo un Imaging tridimensionale di ineguagliabile precisione e l'esame accurato di strutture subcellulari e processi dinamici.
Informazioni su Confocal
La microscopia confocale a scansione laser (CLSM) è una serie di metodi che permettono di ottenere fette da campioni microscopici tramite un'ottica. Il campione rimane intatto e l'affettatura può essere ripetuta più volte. La scansione confocale vera (TCS) è una tecnica in cui viene illuminato e osservato solo un singolo punto alla volta, limitato dalla diffrazione. Il vantaggio dell'imaging confocale è un contrasto nettamente superiore grazie alla rimozione della foschia fuori fuoco. Le sequenze Z di fette ottiche (stack di immagini 3D) possono essere utilizzate per il successivo rendering come anaglifi, mappe con codice di profondità o filmati 3D. Il TCS è anche molto compatibile con l'imaging in multi-fluorescenza, l'imaging time-lapse, le misure FLIM, FRAP e FCS, oltre a un intero mondo di applicazioni spettrali.
Domande frequenti Microscopi confocali
La microscopia crio-confocale prevede che nella fase di preparazione i campioni vengano congelati a basse temperature (in genere inferiori a -150°C) utilizzando azoto liquido e altri liquidi criogenici. Il congelamento criogenico aiuta a proteggere l'integrità strutturale dei campioni ed evita che si formino cristalli di ghiaccio. L'ambiente criogenico stabilizza i campioni preservando le strutture native, riduce il photobleaching e il photodamage e consente di eseguire l'imaging di campioni idratati senza disidratazione né fissazione. La microscopia crio-confocale può essere combinata con la crio-microscopia elettronica (Cryo-EM) per eseguire studi correlativi (CLEM). La Cryo CLEM consente di visualizzare e di analizzare in modo dettagliato i campioni in uno stato quasi nativo, fornendo preziose informazioni sull'organizzazione e l'ultrastruttura di proteine e macromolecole.
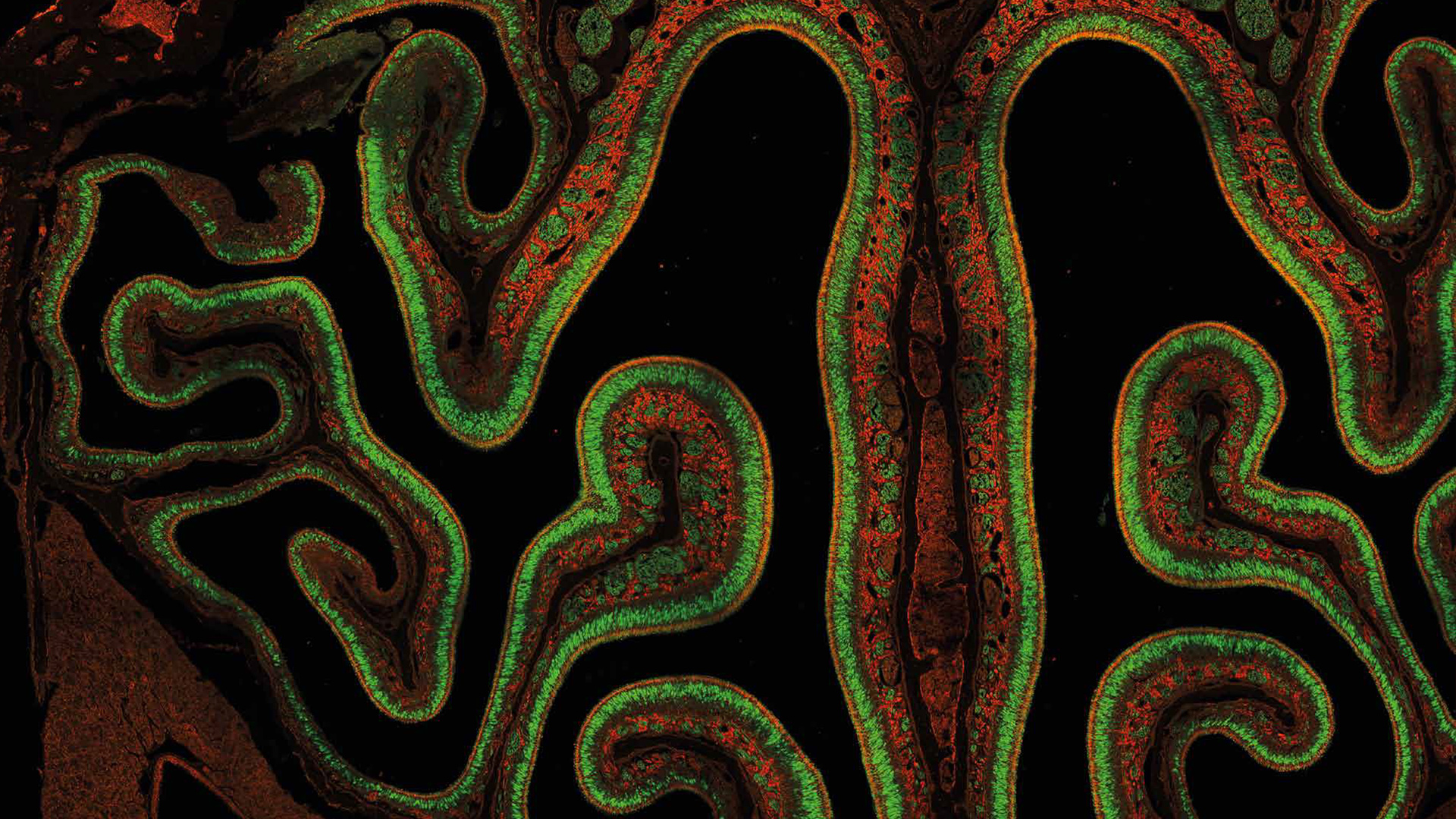
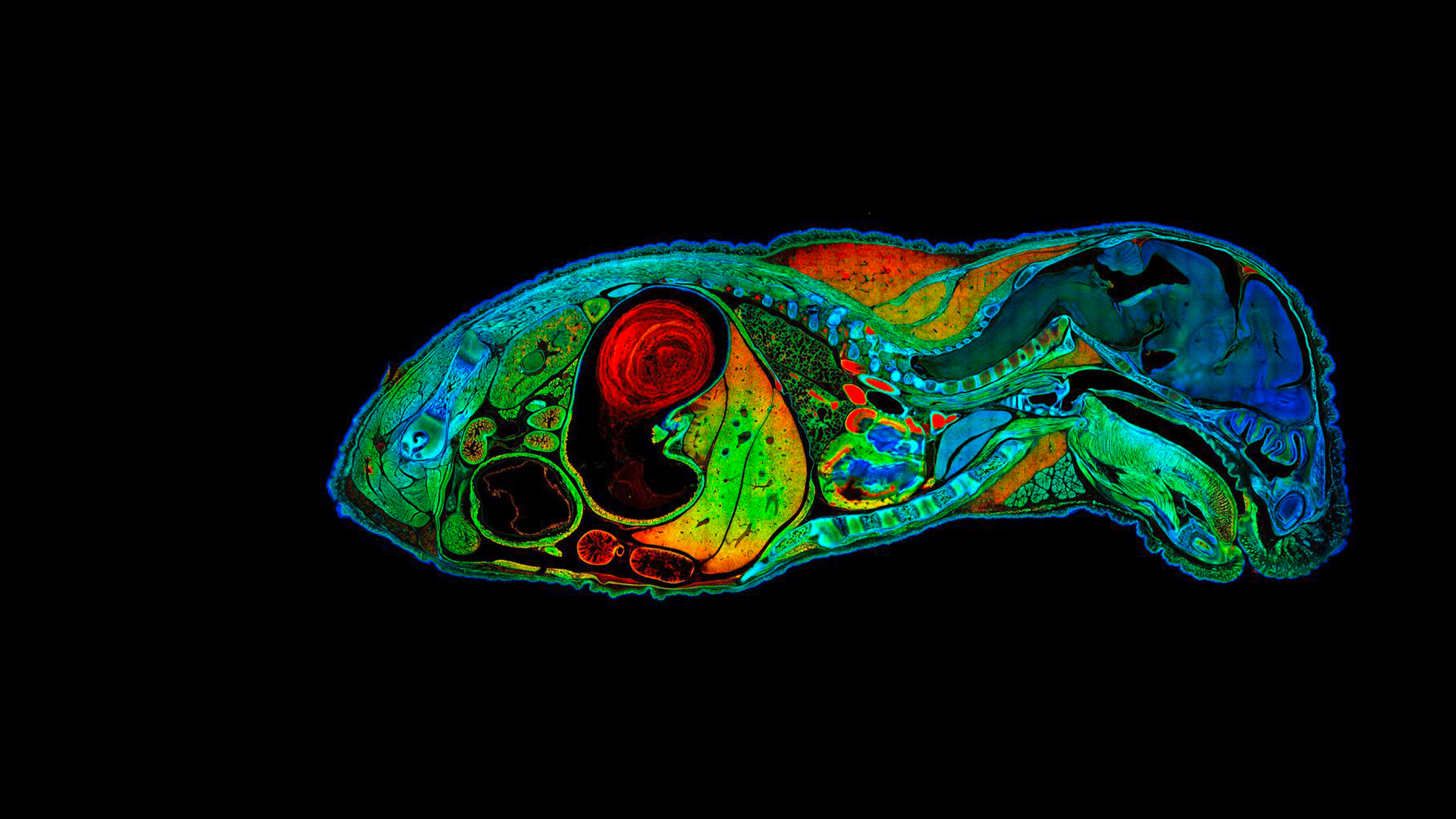
Mosaico di embrione di topo
Mosaico ad alta risoluzione di embrione di topo formato da 722 tessere contenenti 190 Megapixel. Dati FLIM fittati con quattro valori di lifetime di fluorescenza caratteristici, in codice colore. Acquisizione: 1:23 h. Analisi: 1:00 h
Follow us on Instagram